Molecylære chaperoner hjelper til med å folde de fleste proteiner
Undertittel: Maskiner fikser andre maskiner
Tekst og bilder ved Otangelo Grasso. Oversatt herfra.
Se for deg maskiner, som fikser maskiner, som hjelper til med å fikse andre maskiner. Alt ferdig satt opp for å operere på en uavhengig, helautomatisert, robotlignende måte. Tydeligvis krever en slik prosess/system den høyeste type ingeniørkunst og forhåndskunnskap om hva som kan være galt og hvordan man kan fikse feilene. Det er det vi ser i livet.
Video om chaperoner -lenke
Bilde 1. Bindinger til aminosyrer
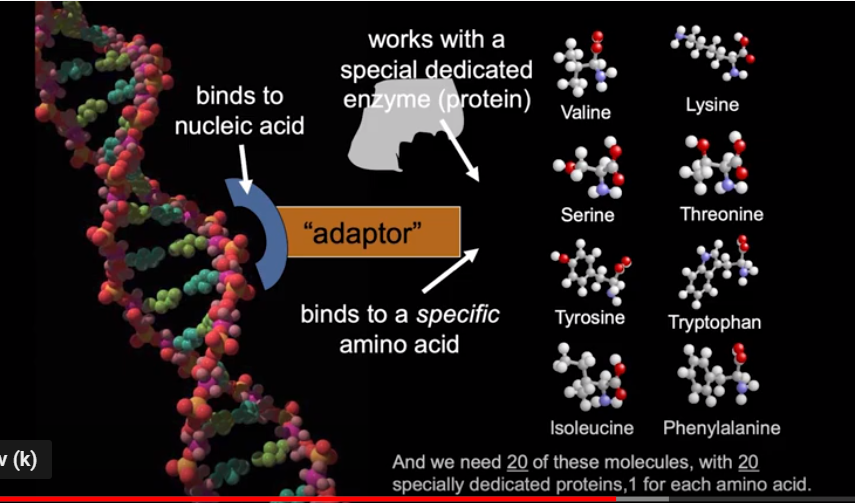 Proteiner, fantastiske deler av kjemisk nanoteknikk, må foldes for å bli funksjonelle, fra lineære til spesifikke 3D-former. Riktig foldede proteiner er avgjørende for livet, fordi de utfører de fleste nødvendige funksjoner i en celle. Hvis det bretter seg til feil form, er et protein ubrukelig. Hvis de første proteinene falt ned i disse dødsdalene, ville livet på jorden aldri ha dukket opp. Spontan folding er ganske rask (millisekunder til sekunder) for mange proteiner, men mange store, kritiske proteiner klarer ikke å finne den riktige formen av seg selv og ville uten hjelp bare bli mye molekylært avfall. Så når et protein folder seg feil, hjelper andre proteiner, kalt chaperoniner, proteiner å folde seg til riktig form. De har vist seg å samhandle med opptil 30 % av cellens proteiner, så deres betydning er reell. Nå, utrolig nok, kan selv disse helt egne proteinene, kalt GroEL, som hjelper feilfoldede proteiner til å brette seg riktig, også feilfolde. Og det har vist seg at GroES, en co-chaperone bistår med å brette GroEL. Fantastisk. Maskiner som hjelper andre maskiner med å montere riktig, er i seg selv gjenstand for feil, og livet har innebygde mekanismer for å fikse også disse maskinene som hjelper til med å fikse andre maskiner !!
Proteiner, fantastiske deler av kjemisk nanoteknikk, må foldes for å bli funksjonelle, fra lineære til spesifikke 3D-former. Riktig foldede proteiner er avgjørende for livet, fordi de utfører de fleste nødvendige funksjoner i en celle. Hvis det bretter seg til feil form, er et protein ubrukelig. Hvis de første proteinene falt ned i disse dødsdalene, ville livet på jorden aldri ha dukket opp. Spontan folding er ganske rask (millisekunder til sekunder) for mange proteiner, men mange store, kritiske proteiner klarer ikke å finne den riktige formen av seg selv og ville uten hjelp bare bli mye molekylært avfall. Så når et protein folder seg feil, hjelper andre proteiner, kalt chaperoniner, proteiner å folde seg til riktig form. De har vist seg å samhandle med opptil 30 % av cellens proteiner, så deres betydning er reell. Nå, utrolig nok, kan selv disse helt egne proteinene, kalt GroEL, som hjelper feilfoldede proteiner til å brette seg riktig, også feilfolde. Og det har vist seg at GroES, en co-chaperone bistår med å brette GroEL. Fantastisk. Maskiner som hjelper andre maskiner med å montere riktig, er i seg selv gjenstand for feil, og livet har innebygde mekanismer for å fikse også disse maskinene som hjelper til med å fikse andre maskiner !!
De fleste proteiner foldes sannsynligvis ikke riktig under syntesen og krever en spesiell klasse proteiner kalt molekylære chaperones for å gjøre det. Molekylære chaperoner er nyttige for celler fordi det er mange forskjellige foldningsveier tilgjengelig for et ikke-foldet eller delvis foldet protein. Uten chaperoner ville noen av disse banene ikke føre til den riktig foldede (og mest stabile) formen fordi proteinet ville bli "kinetisk fanget" i strukturer som er utenfor banen. Noen av disse off-pathway-konfigurasjonene vil samle seg og bli stående som irreversible blindveier av ikke-funksjonelle (og potensielt farlige) strukturer.
Molekylære chaperoner gjenkjenner spesifikt ukorrekte konfigurasjoner utenfor banen ved deres eksponering av hydrofobe overflater, som i riktig foldede proteiner vanligvis er begravet i det indre. Bindingen av disse eksponerte hydrofobe overflatene til hverandre er det som får konformasjoner utenfor banen til å irreversibelt aggregere. I noen tilfeller av arvelige sykdommer hos mennesker, dannes aggregater og kan forårsake alvorlige symptomer og til og med død. Chaperones forhindrer at dette skjer i 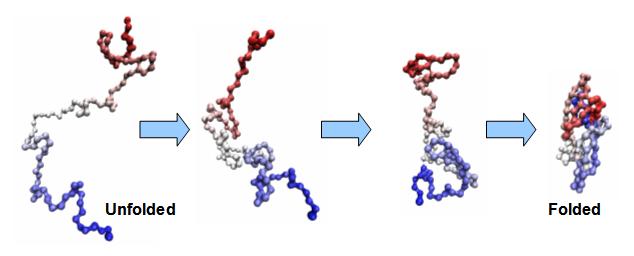 normale proteiner ved å binde seg til de eksponerte hydrofobe overflatene ved å bruke sine egne hydrofobe overflater. Det finnes flere typer chaperones; når de først er bundet til et feil foldet protein, frigjør de det til slutt på en måte som gir proteinet en ny sjanse til å brette seg riktig.
normale proteiner ved å binde seg til de eksponerte hydrofobe overflatene ved å bruke sine egne hydrofobe overflater. Det finnes flere typer chaperones; når de først er bundet til et feil foldet protein, frigjør de det til slutt på en måte som gir proteinet en ny sjanse til å brette seg riktig.
Bilde 2. Eks. på protein-folding
Celler bruker flere typer chaperones
Mange molekylære chaperoner kalles VarmeSjokkProteiner (betegnet VSP), fordi de syntetiseres i dramatisk økte mengder etter en kort eksponering av celler for en forhøyet temperatur (for eksempel 42°C for celler som normalt lever ved 37°C). Dette gjenspeiler driften av et tilbakemeldingssystem som reagerer på en økning i feilfoldede proteiner (som de som produseres av forhøyede temperaturer) ved å øke syntesen av chaperonene som hjelper disse proteinene å refolde seg. Det er flere store familier av molekylære chaperoner, inkludert hsp60- og hsp70-proteinene. Ulike medlemmer av disse familiene fungerer i forskjellige organeller. Dermed inneholder mitokondrier sine egne hsp60- og hsp70-molekyler som er forskjellige fra de som fungerer i cytosolen; og en spesiell hsp70 (kalt BIP) hjelper til med å folde proteiner i endoplasmatisk retikulum. Hsp60- og hsp70-proteinene fungerer hver med sitt eget lille sett med assosierte proteiner når de hjelper andre proteiner å folde seg. Disse hsp-ene deler en affinitet for de eksponerte hydrofobe lappene på ufullstendig foldede proteiner, og de hydrolyserer ATP, og binder og frigjør ofte proteinsubstratet deres med hver syklus av ATP-hydrolyse. I andre henseender fungerer de to typene hsp-proteiner forskjellig. Hsp70-maskineriet virker tidlig i livet til mange proteiner (ofte før proteinet forlater ribosomet), med hver monomer av hsp70 som binder seg til en streng på omtrent fire eller fem hydrofobe aminosyrer (se figuren nedenfor)
Bilde 3. Hsp70-binder-seg-til-aminosyrer
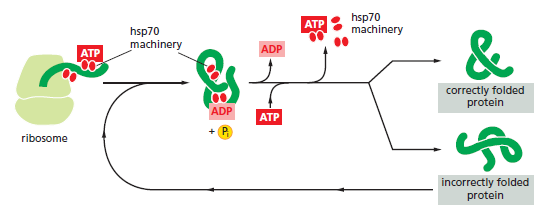
Hsp70-familien av molekylære chaperoner. Disse proteinene virker tidlig, og gjenkjenner en liten strekning av hydrofobe aminosyrer på overflaten til et protein. Hjulpet av et sett med mindre hsp40-proteiner (ikke vist), griper ATP-bundne hsp70-molekyler sitt målprotein og hydrolyserer deretter ATP til ADP, og gjennomgår konformasjonsendringer som får hsp70-molekylene til å assosieres enda tettere med målet. Etter at hsp40 dissosieres, induserer den raske rebindingen av ATP dissosiasjonen av hsp70-proteinet etter ADP-frigjøring. Gjentatte sykluser med hsp-binding og frigjøring hjelper målproteinet med å refolde seg.
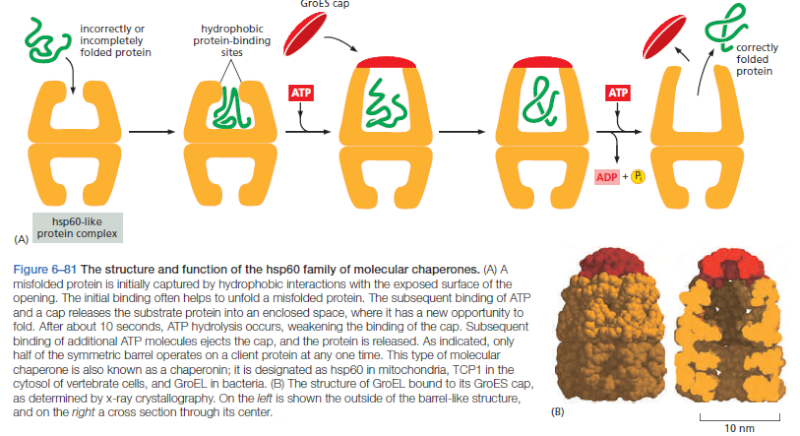
Ved binding av ATP frigjør hsp70 proteinet til løsningen, noe som gir det en sjanse til å refolde seg. I motsetning til dette danner hsp60-lignende proteiner en stor tønneformet struktur som virker etter at et protein er fullstendig syntetisert. Denne typen chaperone, noen ganger kalt en chaperonin, danner et "isolasjonskammer" for foldeprosessen (figur nedenfor).
Bilde 4. Struktur og funksjon hos molekylær chaperon
Fra 41.13 viser denne videoen på en fin måte den fantastiske bevegelsen og funksjonen til denne maskinen:
Vide 2 -lenke
For å komme inn i et kammer fanges først et substratprotein via den hydrofobe inngangen til kammeret. Proteinet frigjøres deretter inn i det indre av kammeret, som er foret med hydrofile overflater, og kammeret forsegles med et lokk, et trinn som krever ATP. Her tillates substratet å brettes til sin endelige konformasjon isolert, der det ikke er andre proteiner å aggregere med. Når ATP hydrolyseres, spretter lokket av, og substratproteinet, enten det er foldet eller ikke, frigjøres fra kammeret. Chaperones trenger ofte mange sykluser med ATP-hydrolyse for å brette en enkelt polypeptidkjede riktig. Denne energien brukes til å utføre mekaniske bevegelser av hsp60 og hsp70 'maskiner', og konverterer dem fra bindende former til frigjørende former. Akkurat som vi så for transkripsjon, spleising og oversettelse, kan forbruket av fri energi brukes av celler for å forbedre nøyaktigheten til en biologisk prosess. Når det gjelder proteinfolding, lar ATP-hydrolyse chaperoner gjenkjenne et bredt utvalg av feilfoldede strukturer, stoppe eventuell ytterligere feilfolding og gjenoppta foldingen av et protein på en ryddig måte.
Spørsmål: Kan denne erkjennelsen være en mekanisme som oppsto på naturlige måter? Hvis ja, hvorfor skulle tilfeldigheter, eller evolusjon eller hvilken som helst naturlig mekanisme antas, produsere en slik enhet som utfører på en så nøyaktig måte for produksjonskontroll, reparasjon og optimalisering? Er ikke det en måldrevet hendelse som må programmeres og oppfinnes? Eller har tankeløs materie noen måldrevne formål? Det er vanskelig å fatte.
Bilde 5. Protein-deler som inngår i folding
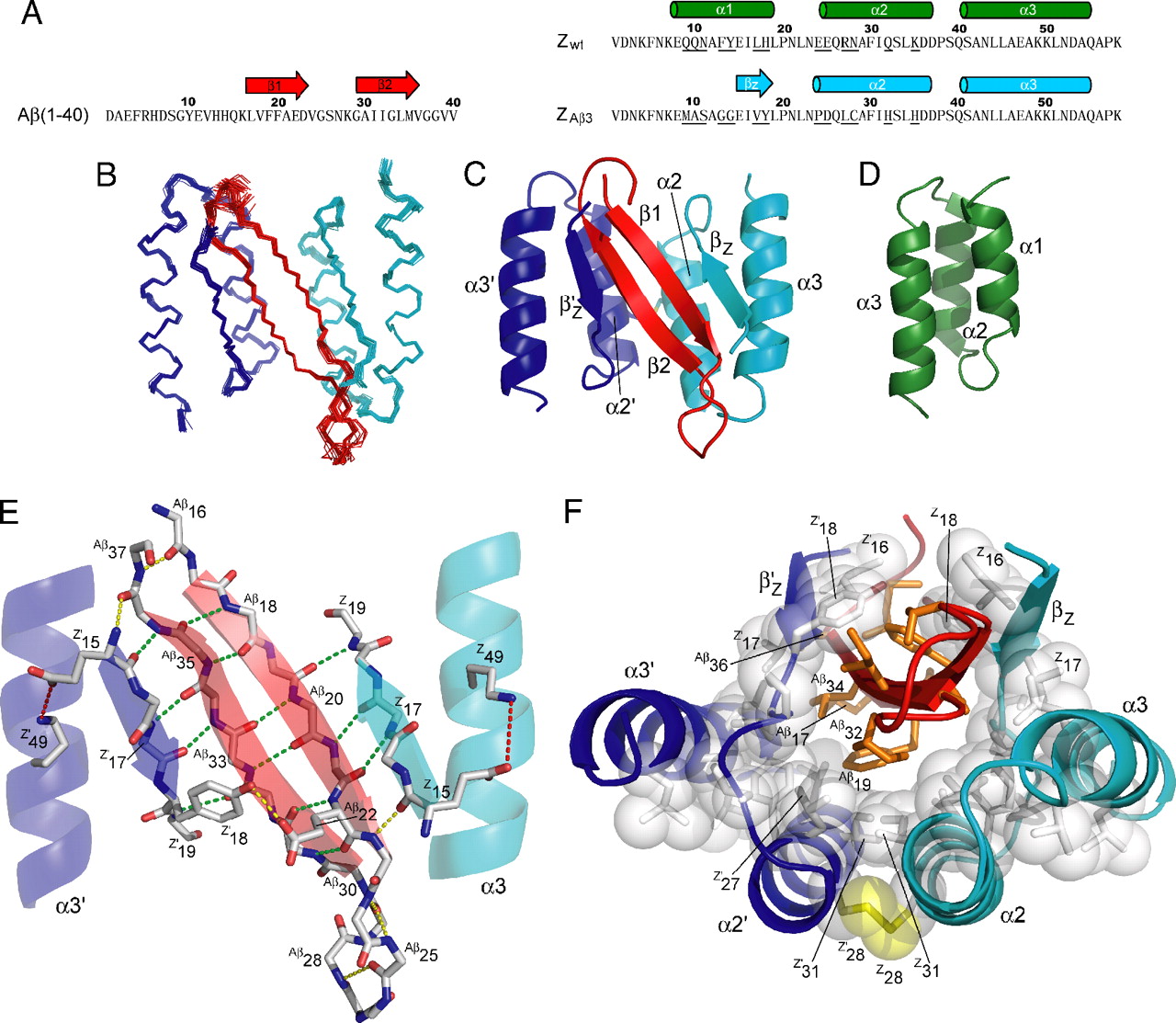 Selv om diskusjonen vår fokuserer på bare to typer ledsagere, har cellen en rekke andre. Det enorme mangfoldet av proteiner i cellene krever antagelig et bredt utvalg av ledsagere med allsidige overvåkings- og korrigeringsmuligheter
Selv om diskusjonen vår fokuserer på bare to typer ledsagere, har cellen en rekke andre. Det enorme mangfoldet av proteiner i cellene krever antagelig et bredt utvalg av ledsagere med allsidige overvåkings- og korrigeringsmuligheter
Eksponerte hydrofobe områder gir kritiske signaler for protein-kvalitetskontroll
Hvis radioaktive aminosyrer legges til cellene i en kort periode, kan de nylig syntetiserte proteinene følges når de modnes til sine endelige funksjonelle former. Denne typen eksperiment viser at hsp70-proteinene virker først, og begynner når et protein fortsatt syntetiseres på et ribosom, og de hsp60-lignende proteinene virker først senere for å hjelpe til med å folde ferdige proteiner. Vi har sett at cellen skiller feilfoldede proteiner, som krever ytterligere runder med ATP-katalysert refolding, fra de med korrekte strukturer gjennom gjenkjennelse av hydrofobe overflater. Vanligvis, hvis et protein har en betydelig eksponert flekk av hydrofobe aminosyrer på overflaten, er det unormalt: det har enten ikke klart å folde seg riktig etter å ha forlatt ribosomet, vært utsatt for en ulykke som delvis utfoldet det på et senere tidspunkt, eller ikke klart å finne dens normale partnerunderenhet i et større proteinkompleks. Et slikt protein er ikke bare ubrukelig for cellen, det kan være farlig.
Proteiner som raskt foldes riktig på egen hånd, viser ikke slike mønstre og omgår generelt ledsagerne. For de andre kan ledsagerne gjennomføre 'proteinreparasjon' ved å gi dem flere sjanser til å folde seg samtidig som de forhindrer aggregering.
Prosessene som overvåker proteinkvalitet etter proteinsyntese. Et nylig syntetisert protein folder seg noen ganger riktig og setter seg sammen av seg selv med partnerproteinene, i så fall lar kvalitetskontrollmekanismene det være i fred. Ufullstendig foldede proteiner får hjelp til å folde seg riktig av molekylære chaperoner: først av en familie av hsp70-proteiner, og deretter, i noen tilfeller, av hsp60-lignende proteiner. For begge typer chaperoner gjenkjennes substratproteinene av en unormalt eksponert flekk av hydrofobe aminosyrer på overflaten. Disse "protein-rescue"-prosessene konkurrerer med en annen mekanisme som, ved å gjenkjenne en unormalt eksponert hydrofob lapp, markerer proteinet for ødeleggelse av proteasomet. Den kombinerte aktiviteten til alle disse prosessene er nødvendig for å  forhindre massiv proteinaggregering i en celle, som kan oppstå når mange hydrofobe områder på proteiner klumper seg sammen uspesifikt.
forhindre massiv proteinaggregering i en celle, som kan oppstå når mange hydrofobe områder på proteiner klumper seg sammen uspesifikt.
BIlde 6. Kvalitetskontrollvalg i en celle
Figuren ovenfor skisserer alle kvalitetskontrollvalgene som en celle gjør for et vanskelig-foldet , nylig syntetisert protein. Som angitt, når forsøk på å folde seg sammen resulterer i en proteinfeil, er en ekstra mekanisme kalt inn som fullstendig ødelegger proteinet ved proteolyse. Denne proteolytiske banen begynner med gjenkjennelsen av en unormal hydrofob lapp på et proteins overflate, og den ender med levering av hele proteinet til en proteinødeleggelsesmaskin, en kompleks protease kjent som proteasomet. Som beskrevet neste, avhenger denne prosessen av et forseggjort proteinmarkeringssystem som også utfører andre sentrale funksjoner i cellen ved å ødelegge utvalgte normale proteiner.
Video 3 -chaperoner i bevegelse -lenke.
Chaperoner er vidundre av molekylær engineering:
Molekylære chaperones fanget på film (1)
'Bevegelsene vi ser i videoene antyder hvordan underenhetene først kan binde proteinet inne i hulrommet, potensielt strekke det for å løsne feilfoldede molekyler, og deretter frigjøre det for å la det finne sin egen struktur i det vandige miljøet inne i hulrommet. samtidig som de binder GroES-lokket for å forhindre at det slipper ut for tidlig, forklarer Saibil. "Hvis proteinet fortsatt viser hydrofobe flekker etter at det er frigjort fra chaperonen, vil det binde seg til en ny GroEL-ring og løpe gjennom syklusen igjen. Når den er riktig brettet, vil den være stabil i cellemiljøet og utføre sin biologiske funksjon.'
Kommentar-Bibelsitat: Åp 15,3 lovsangen som Guds tjener Moses sang, den som også er sangen for Lammet: Store og underfulle er dine gjerninger, Herre Gud, du Allmektige. Rettferdige og sanne er dine veier, du konge over folkeslagene.
Fortsettelse: Chaperon assistert proteinfolding
Proteinfolding er prosessen der nysyntetiserte polypeptidkjeder får de tredimensjonale strukturene som er nødvendige for biologisk funksjon. I mange år ble proteinfolding antatt å skje spontant, på grunnlag av banebrytende eksperimenter til Christian Anfinsen, som viste på slutten av 1950-tallet at rensede proteiner kan foldes av seg selv etter fjerning fra denatureringsmiddel. Anfinsen hadde oppdaget det grunnleggende prinsippet at den lineære aminosyresekvensen inneholder all informasjonen som er nødvendig for å spesifisere et proteins tredimensjonale struktur. Men det ble snart klart at prøverørsfoldeeksperimenter fungerer mest for små, enkeltdomeneproteiner, ofte bare under forhold langt unna de man møter i en celle. Store proteiner klarer ofte ikke å nå naturlig tilstand under disse eksperimentelle forholdene, og danner ikke-funksjonelle aggregater i stedet.
 Det reiser interessante spørsmål: Hvordan bør og kunne naturlige ikke-intelligente naturlige mekanismer forutse nødvendigheten av chaperoner for å oppnå et spesifikt mål og resultat, det vil si funksjonelle proteiner for å lage levende organismer? Ikke-levende materie har ingen naturlig 'drift' eller hensikt eller mål for å bli levende. Laget av proteiner for å skape liv er imidlertid en flertrinnsprosess med mange parallellvirkende komplekse metabolske veier og produksjonslinje-lignende prosesser for å lage proteiner og andre livsviktige produkter som lipider, karbohydrater osv. Riktig folding av proteiner er bare en av flere andre essensielle prosesser for å få et funksjonelt protein. Men et funksjonelt protein i seg selv har ingen funksjon, med mindre det er riktig innebygd gjennom riktig rekkefølge for montering på rett sted.
Det reiser interessante spørsmål: Hvordan bør og kunne naturlige ikke-intelligente naturlige mekanismer forutse nødvendigheten av chaperoner for å oppnå et spesifikt mål og resultat, det vil si funksjonelle proteiner for å lage levende organismer? Ikke-levende materie har ingen naturlig 'drift' eller hensikt eller mål for å bli levende. Laget av proteiner for å skape liv er imidlertid en flertrinnsprosess med mange parallellvirkende komplekse metabolske veier og produksjonslinje-lignende prosesser for å lage proteiner og andre livsviktige produkter som lipider, karbohydrater osv. Riktig folding av proteiner er bare en av flere andre essensielle prosesser for å få et funksjonelt protein. Men et funksjonelt protein i seg selv har ingen funksjon, med mindre det er riktig innebygd gjennom riktig rekkefølge for montering på rett sted.
Til tross for disse problemene var proteinfolding av liten interesse for cellebiologer før på midten og slutten av 1980-tallet, da chaperonehistorien begynte å utspille seg. Som et resultat vet vi nå at i cellene krever mange (kanskje de fleste) proteiner molekylære chaperoner og metabolsk energi for å folde seg effektivt og med en biologisk relevant hastighet. Her beskriver jeg (Grasso), fra et personlig perspektiv, utviklingen som fører til dette nye synet.
Bilde 7. Ulike snitt av chaperoner
GroEL binder underlagene sine i en løst foldet, "smeltet kule"-lignende konformasjon, og eksponerer hydrofobe overflater. Ettersom proteiner i slike tilstander har en tendens til å aggregere, forklarte deres binding av GroEL hvordan aggregering forhindres. Vi fikk også bevis for at minst delvis folding skjedde i forbindelse med GroEL og at denne prosessen var avhengig av tilstedeværelsen av GroES, noe som antyder en innkapslingsmekanisme. GroEL-komplekset består av to stablede, heptameriske ringer. De nye bildene avslørte at GroEL binder utfoldet protein i ringsenteret. GroES, en heptamerisk ring av ~10 kDa underenheter, binder seg som et lokk over det sentrale GroEL-hulrommet, og forårsaker store konformasjonsendringer i de interagerende GroEL-underenhetene. GroEL-GroES-komplekset er asymmetrisk og svært dynamisk, med GroES-binding og avbinding i en mekanisme regulert av GroEL ATPase. GroEL og GroES fungerer i hovedsak som et sammenleggbart bur.
Naturens Skaperens Wink-løsning på problemet med proteinfolding i det overfylte cellulære miljøet virket ekstremt imponerende i sin enkelhet og eleganse: et enkelt proteinmolekyl som brettes i et makromolekylært bur ville ikke være i stand til å aggregere. Imidlertid var bevisene våre for å støtte denne modellen fortsatt indirekte, og mange forskere hadde problemer med å akseptere ideen om et proteinholdig foldebur. krystallstrukturen til GroEL, løst i 1994 av avdøde Paul Sigler i samarbeid med Art Horwich, så ut til å støtte modellen for folding-i-løsning: det sentrale hulrommet til GroEL var rett og slett ikke bredt nok for selv et relativt lite protein som rhodanese for å passe. Denne tolkningen av strukturen tok imidlertid ikke hensyn til at GroEL samarbeider med GroES. Interessant nok, en måned før krystallstrukturen ble publisert, hadde Helen Saibil og hennes kolleger vist ved avansert elektronkryomikroskopi at GroES-binding forårsaker en dramatisk konformasjonsendring i GroEL, noe som resulterte i dannelsen av et stort rom avgrenset av GroES. ATP-avhengig GroES-binding resulterer i proteinfortrengning og innkapsling i det sentrale hulrommet (det såkalte cis-komplekset).
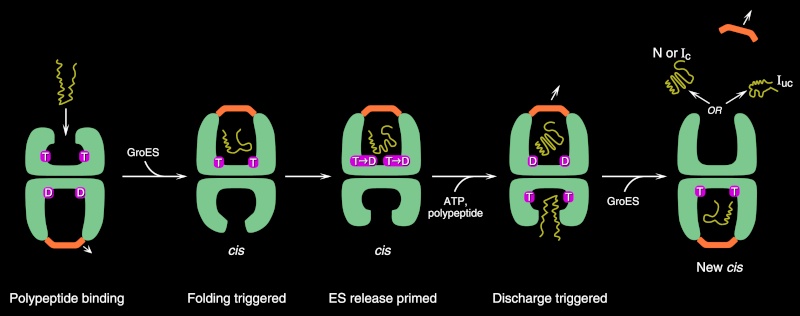 Buret åpner seg igjen etter ~10 s i en reaksjon tidsbestemt av den allosterisk regulerte GroEL ATPase: Når de syv ATP-molekylene i den GroES-bundne GroEL-ringen har blitt hydrolysert, binder ATP seg til trans-ringen, og utløser signalet som får GroES til å løsne seg. Ved å bruke kvantitativ proteomikk i samarbeid med Matthias Mann, viste vi i 2005 at minst 250 forskjellige proteiner interagerer med GroEL ved syntese (~10% av cytosoliske proteiner).
Buret åpner seg igjen etter ~10 s i en reaksjon tidsbestemt av den allosterisk regulerte GroEL ATPase: Når de syv ATP-molekylene i den GroES-bundne GroEL-ringen har blitt hydrolysert, binder ATP seg til trans-ringen, og utløser signalet som får GroES til å løsne seg. Ved å bruke kvantitativ proteomikk i samarbeid med Matthias Mann, viste vi i 2005 at minst 250 forskjellige proteiner interagerer med GroEL ved syntese (~10% av cytosoliske proteiner).
Bilde 8. Forløp av polypeptid bindinger
Hæ... Hvordan kunne naturlige mekanismer ha oppnådd det ?? 
Av disse er 60–80 proteiner absolutt GroELGroES-avhengige, inkludert en rekke essensielle proteiner. De er vanligvis under ~60 kDa i størrelse og kan innkvarteres av chaperonin-buret. Interessant nok har mange GroEL-avhengige proteiner komplekse fold-topologier som omfatter en blanding av a-helikser og b-sheets, for eksempel TIM-tønnen, og er kjent for deres tendens til å befolke kinetisk fangede tilstander under folding. Vi foreslo at det begrensende miljøet til chaperonin-buret ikke bare forhindrer aggregering, men også kan jevne ut robuste bretteenergilandskap, slik at folding kan skje innenfor en biologisk relevant tidsramme.
Celler inneholder minst én annen type ATP-avhengig chaperon, Hsp70, som også interagerer med nylig syntetiserte proteiner. Men hva var forholdet mellom Hsp70 og chaperonin-systemene, og samarbeidet de i proteinfolding? Det var bevis for at Hsp70 binder hydrofobe peptider44 og kan assosieres med begynnende polypeptidkjeder som kommer fra ribosomer, det vil si på et stadium når polypeptidet er strukturelt ufullstendig og ennå ikke er i stand til å foldes. Når vi tok dette i betraktning, så vi for oss en sammenhengende vei der Hsp70 ville samhandle med den (voksende) polypeptidkjeden, forhindre for tidlig feilfolding og aggregering (det negative prinsippet), og deretter ville GroEL-GroES formidle folding av det fullførte proteinet til den opprinnelige tilstanden (det positive prinsippet)
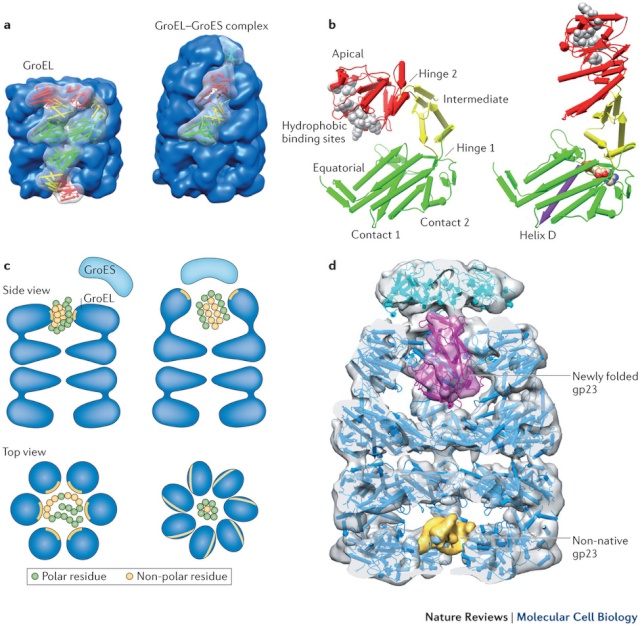
Ledermaskiner for proteinfolding, utfolding og disaggregering (1)
Bilde 9: Chaperon-maskiner
a) Oversikt over uligandert (apo) GroEL (til venstre) og GroEL–GroES-komplekset (til høyre). De generelle formene er vist som blå overflater, med tre underenheter farget etter domene i rødt, grønt og gult i apo GroEL. En underenhet av GroEL og en av GroES (cyan) er uthevet i GroEL–GroES-komplekset.
b) Konformasjon av en GroEL-underenhet i apo-formen (venstre) og GroES-bundet form (til høyre), med GroEL-nøkkelsteder indikert (GroES er ikke vist).
c) Tegneserier av komplekser med foldeproteiner. Hydrofobe overflater og rester er vist i gult og polare rester i grønt.
d) Åpen visning av kryo-elektronmikroskopistrukturen til GroEL i kompleks med bakteriofagkapsidprotein, med en ikke-native gp23 bundet til begge ringene64. Den rosa tettheten i foldekammeret tilsvarer nyfoldet gp23, og den gule tettheten i den åpne ringen er en del av en ikke naturlig-tilhørende gp23-underenhet. De tilsvarende atomstrukturene er vist innebygd i elektronmikroskop-itensitetskartet, bortsett fra det ikke-native substratet, som er ukjent og bare delvis visualisert på grunn av uorden. Den åpne ringen med sin hydrofobe foring er akseptor-tilstanden for ikke naturlig-tilhørende polypeptider, og binding til flere steder kan lette utfoldingen. ATP og GroES binding til chaperonin skaper et beskyttet kammer med en hydrofil foring som lar det innkapslede proteinet foldes.
Slike sammenstillinger, kalt chaperoniner, finnes også i andre cellulære rom og er essensielle komponenter, som medierer proteinfolding under både varmesjokk og normale forhold. Helt siden 1987 har vi studert disse fascinerende molekylene både in vivo og in vitro, med spesiell vekt på Hsp60-homologen i E. coli kjent som GroEL. Vi og andre fant tidlig at en chaperonin-mediert folingsreaksjon kan rekonstitueres i et reagensrør, og det har muliggjort strukturelle og funksjonelle studier som har begynt å forklare hvordan chaperoniner virker. Spesielt en kombinasjon av krystallografiske studier, med avdøde Paul Siglers gruppe her ved Yale, og funksjonelle studier, ved bruk av dynamiske studier av en rekke mutante chaperoniner, har begynt å avsløre hvordan disse chaperoninene fungerer. Det skjematiske diagrammet nedenfor oppsummerer vårt nåværende syn på den chaperonin-medierte proteinfoldingsveien. (2)
Oversettelse ved Asbjørn Lund Proteiner, fantastiske deler av kjemisk nanoteknikk, må foldes for å bli funksjonelle, fra lineære til spesifikke 3D-former. Riktig foldede proteiner er avgjørende for livet, fordi de utfører de fleste nødvendige funksjoner i en celle. Hvis det bretter seg til feil form, er et protein ubrukelig. Hvis de første proteinene falt ned i disse dødsdalene, ville livet på jorden aldri ha dukket opp. Spontan folding er ganske rask (millisekunder til sekunder) for mange proteiner, men mange store, kritiske proteiner klarer ikke å finne den riktige formen av seg selv og ville uten hjelp bare bli mye molekylært avfall. Så når et protein folder seg feil, hjelper andre proteiner, kalt chaperoniner, proteiner å folde seg til riktig form. De har vist seg å samhandle med opptil 30 % av cellens proteiner, så deres betydning er reell. Nå, utrolig nok, kan selv disse helt egne proteinene, kalt GroEL, som hjelper feilfoldede proteiner til å brette seg riktig, også feilfolde. Og det har vist seg at GroES, en co-chaperone bistår med å brette GroEL. Fantastisk. Maskiner som hjelper andre maskiner med å montere riktig, er i seg selv gjenstand for feil, og livet har innebygde mekanismer for å fikse også disse maskinene som hjelper til med å fikse andre maskiner !!
Proteiner, fantastiske deler av kjemisk nanoteknikk, må foldes for å bli funksjonelle, fra lineære til spesifikke 3D-former. Riktig foldede proteiner er avgjørende for livet, fordi de utfører de fleste nødvendige funksjoner i en celle. Hvis det bretter seg til feil form, er et protein ubrukelig. Hvis de første proteinene falt ned i disse dødsdalene, ville livet på jorden aldri ha dukket opp. Spontan folding er ganske rask (millisekunder til sekunder) for mange proteiner, men mange store, kritiske proteiner klarer ikke å finne den riktige formen av seg selv og ville uten hjelp bare bli mye molekylært avfall. Så når et protein folder seg feil, hjelper andre proteiner, kalt chaperoniner, proteiner å folde seg til riktig form. De har vist seg å samhandle med opptil 30 % av cellens proteiner, så deres betydning er reell. Nå, utrolig nok, kan selv disse helt egne proteinene, kalt GroEL, som hjelper feilfoldede proteiner til å brette seg riktig, også feilfolde. Og det har vist seg at GroES, en co-chaperone bistår med å brette GroEL. Fantastisk. Maskiner som hjelper andre maskiner med å montere riktig, er i seg selv gjenstand for feil, og livet har innebygde mekanismer for å fikse også disse maskinene som hjelper til med å fikse andre maskiner !! normale proteiner ved å binde seg til de eksponerte hydrofobe overflatene ved å bruke sine egne hydrofobe overflater. Det finnes flere typer chaperones; når de først er bundet til et feil foldet protein, frigjør de det til slutt på en måte som gir proteinet en ny sjanse til å brette seg riktig.
normale proteiner ved å binde seg til de eksponerte hydrofobe overflatene ved å bruke sine egne hydrofobe overflater. Det finnes flere typer chaperones; når de først er bundet til et feil foldet protein, frigjør de det til slutt på en måte som gir proteinet en ny sjanse til å brette seg riktig.

 Selv om diskusjonen vår fokuserer på bare to typer ledsagere, har cellen en rekke andre. Det enorme mangfoldet av proteiner i cellene krever antagelig et bredt utvalg av ledsagere med allsidige overvåkings- og korrigeringsmuligheter
Selv om diskusjonen vår fokuserer på bare to typer ledsagere, har cellen en rekke andre. Det enorme mangfoldet av proteiner i cellene krever antagelig et bredt utvalg av ledsagere med allsidige overvåkings- og korrigeringsmuligheter forhindre massiv proteinaggregering i en celle, som kan oppstå når mange hydrofobe områder på proteiner klumper seg sammen uspesifikt.
forhindre massiv proteinaggregering i en celle, som kan oppstå når mange hydrofobe områder på proteiner klumper seg sammen uspesifikt. Det reiser interessante spørsmål: Hvordan bør og kunne naturlige ikke-intelligente naturlige mekanismer forutse nødvendigheten av chaperoner for å oppnå et spesifikt mål og resultat, det vil si funksjonelle proteiner for å lage levende organismer? Ikke-levende materie har ingen naturlig 'drift' eller hensikt eller mål for å bli levende. Laget av proteiner for å skape liv er imidlertid en flertrinnsprosess med mange parallellvirkende komplekse metabolske veier og produksjonslinje-lignende prosesser for å lage proteiner og andre livsviktige produkter som lipider, karbohydrater osv. Riktig folding av proteiner er bare en av flere andre essensielle prosesser for å få et funksjonelt protein. Men et funksjonelt protein i seg selv har ingen funksjon, med mindre det er riktig innebygd gjennom riktig rekkefølge for montering på rett sted.
Det reiser interessante spørsmål: Hvordan bør og kunne naturlige ikke-intelligente naturlige mekanismer forutse nødvendigheten av chaperoner for å oppnå et spesifikt mål og resultat, det vil si funksjonelle proteiner for å lage levende organismer? Ikke-levende materie har ingen naturlig 'drift' eller hensikt eller mål for å bli levende. Laget av proteiner for å skape liv er imidlertid en flertrinnsprosess med mange parallellvirkende komplekse metabolske veier og produksjonslinje-lignende prosesser for å lage proteiner og andre livsviktige produkter som lipider, karbohydrater osv. Riktig folding av proteiner er bare en av flere andre essensielle prosesser for å få et funksjonelt protein. Men et funksjonelt protein i seg selv har ingen funksjon, med mindre det er riktig innebygd gjennom riktig rekkefølge for montering på rett sted. Buret åpner seg igjen etter ~10 s i en reaksjon tidsbestemt av den allosterisk regulerte GroEL ATPase: Når de syv ATP-molekylene i den GroES-bundne GroEL-ringen har blitt hydrolysert, binder ATP seg til trans-ringen, og utløser signalet som får GroES til å løsne seg. Ved å bruke kvantitativ proteomikk i samarbeid med Matthias Mann, viste vi i 2005 at minst 250 forskjellige proteiner interagerer med GroEL ved syntese (~10% av cytosoliske proteiner).
Buret åpner seg igjen etter ~10 s i en reaksjon tidsbestemt av den allosterisk regulerte GroEL ATPase: Når de syv ATP-molekylene i den GroES-bundne GroEL-ringen har blitt hydrolysert, binder ATP seg til trans-ringen, og utløser signalet som får GroES til å løsne seg. Ved å bruke kvantitativ proteomikk i samarbeid med Matthias Mann, viste vi i 2005 at minst 250 forskjellige proteiner interagerer med GroEL ved syntese (~10% av cytosoliske proteiner).